臨時セミナーのお知らせ
構造分子薬理学分野(仮)では、以下の通り微小管切断酵素カタニンに関する臨時セミナーを開催しますので、皆さまご参集ください。
演者 岩谷奈央子氏 (神戸大学医学部非常勤技術補佐員)
日時 11月10日木曜日 午後16:00~17:20
場所 高等総合研究館1F会議室
演題 MOLECULAR MECHANISM OF MICROTUBULE-SEVERING BY KATANIN P60
(カタニンP60の微小管切断機構に関する研究)
細胞骨格の一つである微小管はチューブリン蛋白質のGTP依存的な重合によって形成されており、細胞の運動や細胞内の物質輸送をつかさどる。その挙動は極めてダイナミックで、微小管に作用する蛋白質やカルシウム等の様々な分子の制御を受けている。微小管の細胞内ダイナミクスを理解するためには、それら制御因子の動作機構を解明する必要がある。本講演では、制御因子の一つで、微小管をATP依存的に分解する蛋白質であるカタニンP60(以降、KP60と呼ぶ)に注目し、その分子レベルでの働きを解明することを目的として研究を行ったので報告する。
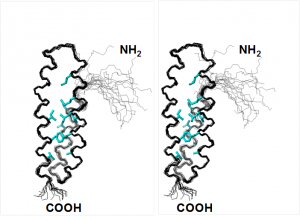
まず、演者は、KP60のアミノ末端領域から、立体構造の自立的な最小単位である蛋白質ドメインの同定・単離に成功した(以降、このドメインをKP60-NTDと呼ぶ)。その過程において、KP60-NTDが疎水性アミノ酸残基の相互作用により、コイルドコイルと呼ばれる高次会合体を形成してしまい、解析が困難になった。そこで、単量体蛋白質試料を得るために1H-15N相関スペクトルを指標として、KP60-NTDのアミノ酸配列の最適化を行い、方法論として確立した。このドメイン境界の最適化手法は、立体構造解析と機能解析に適した理想的な蛋白質試料の調製法として広く適用可能である。
ついで、演者は異種核多次元NMR法により、得られたKP60-NTDの立体構造を世界で初めて決定した。さらに、生化学実験により、KP60-NTDがチューブリンと結合することを明らかにし、その相互作用部位を決定した。さらに生化学的研究により、KP60の微小管分解活性がカルシウムによって抑制されることを発見するとともに、NMR法により、KP60-NTDのカルシウム結合部位を決定した。加えて、上記の知見を総合して、このカルシウム結合部位近傍が、カタニンの微小管分解における酵素活性の負の制御に関わるという新規の仮説を提案するに至った。