学術的背景
新型コロナウイルス(SARS-CoV-2)に対する創薬研究を行うにあたり、禁煙ウイルスであるSARS-CoVの種々のタンパク質における先行研究を参考にした。我々は、これまで培ってきたNMRを用いたタンパク質・タンパク質相互作用阻害剤開発のノウハウを、新型コロナウイルスの治療や予防に役立てたいと考え、まず創薬標的となるタンパク質について調査した。
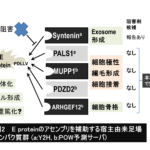
その結果、SARS-CoV-2のエンベロープタンパク質(E protein)と高度にアミノ酸が保存されている、SARS-CoVのE proteinのC末端に、宿主の複数の足場タンパク質のPDZドメインに結合しうるモチーフDLLVがあることが報告されていることに気づいた(Jimenez-Guarderio, 2014, Plos Pathogen)。PDZドメインとは、構造分子薬理学分野で長らく研究対象としているヒトゲノム中におよそ280コピー存在する100アミノ酸程度の球状タンパク質ドメインである [PDZ domain 英語版wikipedia参照のこと]。この論文の著者らは、変異実験よりこのモチーフがSARS-CoVの病原性の強さに関連すること、モデル細胞種によってウイルス産生量を70-90%減少させることを報告している。この論文では、E proteinはヒトタンパク質Syntenin-1にPDZモチーフを介して結合すると報告されている。
他方、SARS-E proteinの過剰発現は上皮細胞のタイトジャンクション(TJ)や細胞骨格の異常をもたらす(Teoh, 2010, MBoC)。TJは細胞接着装置の一つであり、細胞と細胞の隙間に存在しバリア機能を発揮するための膜タンパク質複合体である。この論文では、TJ形成を促進し機能と形態を維持するタンパク質の一つ、PALS1のPDZドメインが、E proteinの結合パートナーであろうと、報告している。構造分子薬理学分野では、もう一つの主要テーマとして、TJを制御する二つの鍵タンパク質、ZO-1とLNX1について、多くの研究をしてきており、また、それらのタンパク質の阻害剤も複数発見してきている。
他方、これまでに、E proteinはゴルジ膜上でイオンチャネルを形成するvirioporinであるという報告があり(PMID:15527857, 19593379, 29474890, 他多数)、イオン透過活性とウイルスの生態・病原性には相関があると予測されており、イオンチャネル阻害剤の開発を進めているグループもある。その活性とPDZ結合モチーフの関係は明らかでない。
また、我々は、まだヒト細胞内に、E proteinの標的となるPDZドメインのうち検証されていないものが、少なくともあと4つ存在すると考えている。具体的には MPDZ(MUPP1)-PDZ5, MPDZ-PDZ6, PDZD2-PDZ, ARHGEF12(LARG)-PDZである。これらは、トロント大のBader教授らが開発した方法(POW server)で予測された。
通常PDZドメインを持つ細胞内足場タンパク質は、膜タンパク質のC末端に結合して、その細胞内局在を制御したり、細胞膜やオルガネラ膜上での多量体化を補助したりすることが知られている。E protein – ヒト細胞PDZドメインの相互作用の薬剤による妨害は、ウイルスエンベロープタンパク質が成熟してウイルス粒子が形成される過程のどこかで、阻害活性を発揮できるかもしれない、と考えた。
我々、構造分子薬理学分野の廣明グループは、これまでにPDZドメインの構造生物学研究ならびに、その立体構造情報を高度に活用した創薬研究をおこなってきた。これまでに、4種のPDZドメインと複合体の立体構造決定を行い、PDBデータベースには9件のエントリー(PDB: 2RRM, 3AXA, 3VQG, 3VQF, 他5個は公開前)を登録している。すでに、ZO1-PDZ1ドメイン、LNX1-PDZ2ドメイン、Dvl-PDZの阻害剤をそれぞれ発見しており、特許出願済みである。そのような経緯のもと、これまで買いそろえたPDZに結合しそうな候補化合物のストックは38個におよび、結合を調べるための15N標識タンパク質のNMR試料が手元にあれば、NMRを用いた低分子の相互作用の確認実験がすぐにも可能である。
本プロジェクトでは、構造分子薬理学分野で、大学院生(高木)がその主要な実験を進めて、抗コロナウイルス薬のシーズの探索を行い、一部その目的を達成した。
目的1:E proteinのC末端と、それに結合する宿主タンパク質候補(syntenin、PALS1、他)のPDZドメインとの相互作用を阻害する低分子医薬品のシード化合物を発見した。複数の化合物を大阪医科大の鈴木講師に提供し、SARS-CoV-2を感染させたCalu-3細胞でその活性を評価したところ、2つの化合物に抗ウイルス活性が認められた。その知見をもとに、さらにインシリコ探索を行い、10倍程度活性をあげた第2世代シード化合物を同定することを計画中である。
目的2:E proteinのC末端に結合する宿主タンパク質のうち、最も重要な標的タンパク質を決定し、可能ならば一つに絞る。その知見に基づき、1の化合物の更なる合成展開を支える高速簡便なアッセイ法を確立した。
目的3:2で確定した標的PDZドメインと、1の化合物の複合体の立体構造を決定し、立体構造に指南されたリード化合物最適化に資する構造情報を得る。
※なお上記のプロジェクト内容を骨子とした研究提案は、令和2年度 「新興・再興感染症に対する革新的医薬品等開発推進研究事業(新型コロナウイルス感染症(COVID-19)に対する研究)」(5次公募)に申請し、採択された。
※上記のような研究プロジェクトにぜひ参加したいという、理学部生命理学科の卒業研究生、および創薬科学研究科の大学院生を募集中です。
2021.3.13