生体の基本単位は細胞であり、それは細胞膜によって外界と区切られている。すなわち、多くの細胞機能は生体膜を介して細胞内外の環境に適応することで維持されているため、膜生物学研究は今日まで世界における生物学上の最重要研究課題のひとつになっている。一方、真核生物の細胞は、単純な脂質二重膜の袋ではなく、オルガネラ膜や輸送小胞など、多種多様な膜成分が細胞内に混在している。特に、これらに対して適切に蛋白質が局在しなければその正しい機能の発現は行われない。こうした生体膜機能の維持と構造形成の破綻ががんや循環器/神経疾患・生活習慣病など多くの重要疾患の原因となっているため、その根本原理を解明することの社会的意義は小さくない.にもかかわらず,近年の莫大な生命科学の知識の集積と著しい科学技術の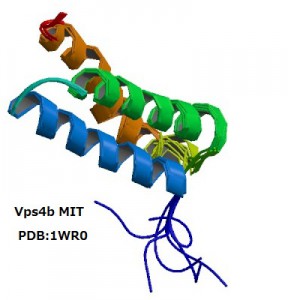 進歩は、膜に存在する個々の機能分子の解明をこそもたらしたものの、統合的全体像の理解にはいたっていない.特に,受容体や細胞接着因子などの重要な膜機能分子が自律的に集積して,システムとしての生体膜が機能する仕組みはほとんど解明されていない。これは、膜に結合した状態でのこれらの分子や超分子複合体の構造機能解析が困難であることが主な原因である.ここに問題解決の余地がある.すなわち,生体膜の全体像を統合的アプローチにより多面的に解明することが重要であり、ひとたび全体像を理解すれば、多くの疾患の革新的な診断法や治療法の開発に結び付けることが可能である.
進歩は、膜に存在する個々の機能分子の解明をこそもたらしたものの、統合的全体像の理解にはいたっていない.特に,受容体や細胞接着因子などの重要な膜機能分子が自律的に集積して,システムとしての生体膜が機能する仕組みはほとんど解明されていない。これは、膜に結合した状態でのこれらの分子や超分子複合体の構造機能解析が困難であることが主な原因である.ここに問題解決の余地がある.すなわち,生体膜の全体像を統合的アプローチにより多面的に解明することが重要であり、ひとたび全体像を理解すれば、多くの疾患の革新的な診断法や治療法の開発に結び付けることが可能である.
上記のような観点から、我々の研究グループはこれまでに微量脂質であるホスホイノシチドに結合するタンパク質の探索とその立体構造解析を行ってきた。たとえば、エンドソームに特徴的なPI3Pを特異的に認識するPXドメインの溶液構造や、PI4Pを弱く認識しつつペルオキシソーム表面で他のタンパク質の輸送を助けるPEX1のN末端ドメインの結晶解析、後期エンドソーム表面でマルチベシキュラーボディ形成にかかわるATPase、VPS4BのMITドメインの溶液構造決定などがこれにあたる。
われわれが得意とするPRESAT-vectorクローニング法を利用した、高速パラレル発現系調製技術は、こうした新しいドメイ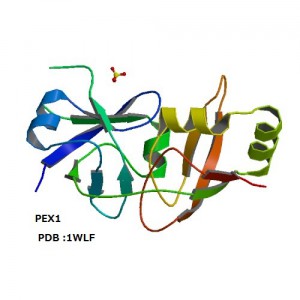 ンの生化学・構造生物学にきわめて有効である。
ンの生化学・構造生物学にきわめて有効である。
蛋白質と膜成分(ミセル、リポソーム)の相互作用を原子レベルで調べるためには、困難な結晶化を達成しなければならないことが多いためX線結晶解析学はこの目的には必ずしも向かない。そこで相互作用観察にはNMRを、立体構造決定にはX線を、多量体の観察には電子顕微鏡用いて、脂質結合蛋白質や膜構造変換蛋白質群の解析をおこなっていこうというのが本研究室の基本戦略である。
神戸大学大学院バイオシグナル研究センターの伊藤研究室とも共同研究を行い、リサイクリングエンドソーム、後期エンドソーム、マクロピノサイトーシス、および形質膜のプロトルージョンに関連する膜構造変換因子に特に着目して今後の研究を進めていく。